L’osservazione del comportamento dei gas variando il volume e la temperatura, lasciando costante la pressione, e variando la pressione e la temperatura, lasciando costante il volume, permette di scrivere tre leggi importanti della Fisica.
Riprendiamo il discorso dell’articolo precedente: per esplorare il comportamento del gas, dobbiamo realizzare due altri esperimenti:
- variamo volume e temperatura, a pressione costante;
- variamo pressione e temperatura, a volume costante.
Iniziamo con il primo: cosa ci serve per il nostro esperimento? Per far variare il volume abbiamo ancora bisogno del cilindro con pistone; però, a pressione costante non dobbiamo più cambiare i pesi. Poi, abbiamo bisogno di riscaldare e raffreddare il gas. Infine, abbiamo bisogno di un termometro, che ci indichi la temperatura del gas, ed abbiamo anche bisogno di isolare termicamente il nostro cilindro, dopo averlo scaldato o raffreddato, in modo che la temperatura rimanga costante abbastanza a lungo per misurarla.
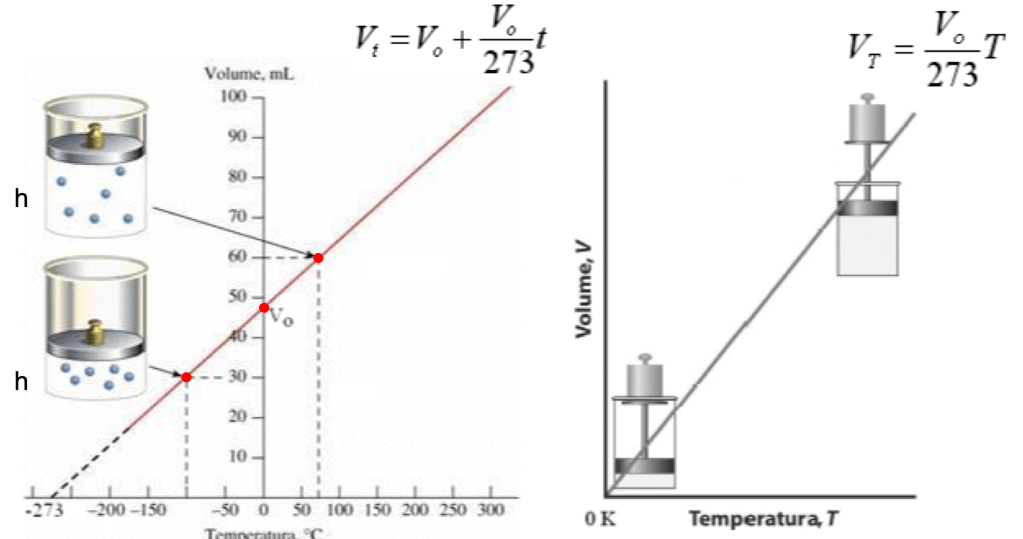
Cominciamo a guardare l’immagine di sinistra. Abbiamo un cilindro con sopra un certo peso: poiché non cambiamo il peso, operiamo a pressione costante. All’esterno, non indicato, abbiamo un dispositivo che ci consente di riscaldare o di raffreddare il tutto.
Iniziamo il nostro esperimento misurando il volume V0 del gas quando la temperatura è di 0 °C: dal diagramma si legge V0 = 48 ml. Riportiamo le misure sul diagramma: in ascissa mettiamo la temperatura, in °C; nell’ordinata mettiamo il volume del gas, in ml (o cc), che è dato dalla sezione S del cilindro, costante, moltiplicato per l’altezza h del cilindro rispetto alla base.
Ora aumentiamo la temperatura, ad esempio a 70 °C: il volume aumenta a 60 ml. Ora, invece, raffreddiamo, e portiamo il tutto a – 100 °C: il volume si riduce a 30 ml.
Osserviamo il diagramma: i tre punti misurati sono allineati su una retta. Possiamo eseguire altre misure simili: i punti sono sempre allineati! Ma allora, la relazione tra volume e temperatura, a pressione costante, è di proporzionalità! Nel 1787, Jacques Charles pubblicò il risultato:
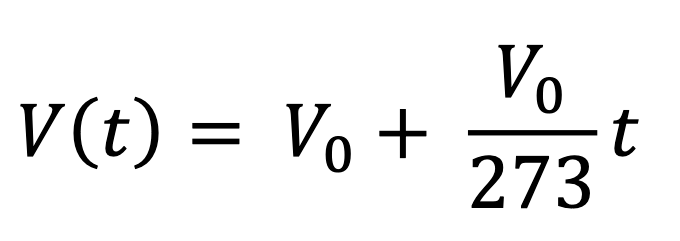
Questa legge è anche chiamata prima legge di Joseph Gay-Lussac. Forse avete già notato che la retta interseca l’asse delle ascisse: il volume del gas vale zero alla temperatura di – 273 °C (esattamente, – 273,15 °C). Ebbene, con questo semplice esperimento abbiamo scoperto un valore assoluto della fisica: nessun corpo può avere una temperatura inferiore allo zero assoluto! Ecco come è stato scoperto questo valore, di cui vi ho parlato nell’articolo precedente!
Se, invece di misurare la temperatura in °C, la misuriamo in K, cosa succede della formula? Diventa ancora più semplice:
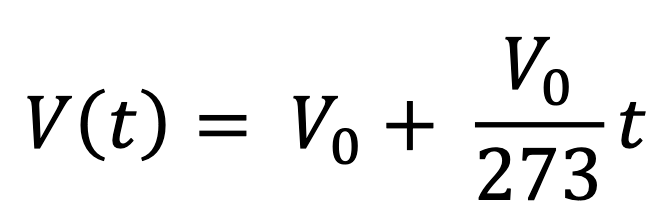
Attenzione! Il nostro V0 NON È un valore costante: dipende dalla pressione a cui abbiamo condotto l’esperimento! Ecco cosa succede con pressioni diverse.
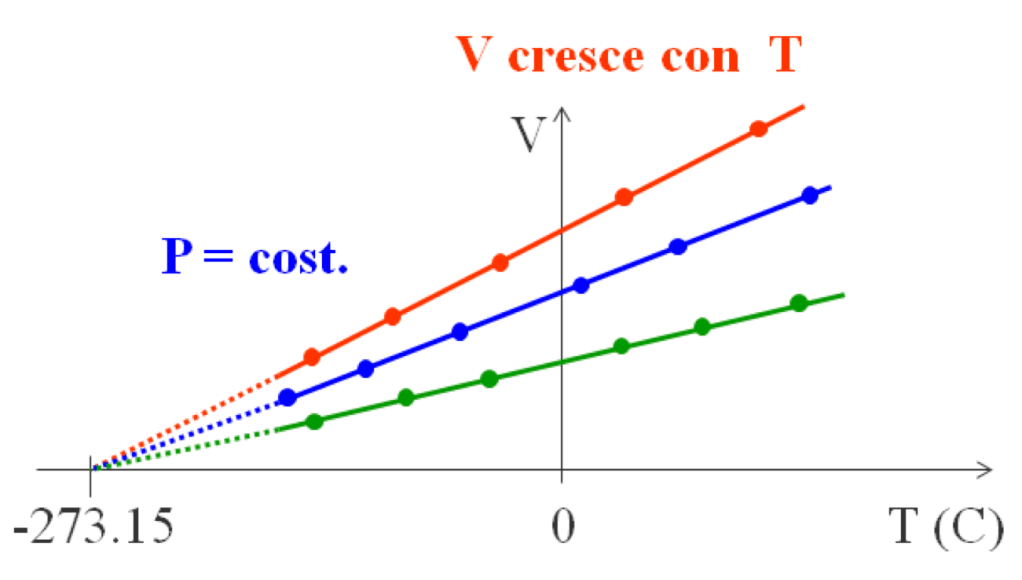
Come potete osservare, la legge è la stessa: tutte le rette s’intersecano a -273,15 °C.
Bene: ora ci rimane da studiare cosa succede conducendo il nostro esperimento a volume costante, facendo variare pressione e temperatura. L’apparato di prova è analogo al precedente; però, invece di tenere la pressione costante, teniamo costante il volume.
Ecco qui il dispositivo ed il diagramma delle misure effettuate.

Rispetto al diagramma precedente, V è costante, e P varia; però, l’espressione è la stessa! Anche in questo caso, chiamiamo P0 la pressione alla temperatura di 0 °C; dopo ciò, se scaldiamo o raffreddiamo il gas, mantenendolo a volume costante, vediamo che la pressione è proporzionale alla temperatura secondo la formula:
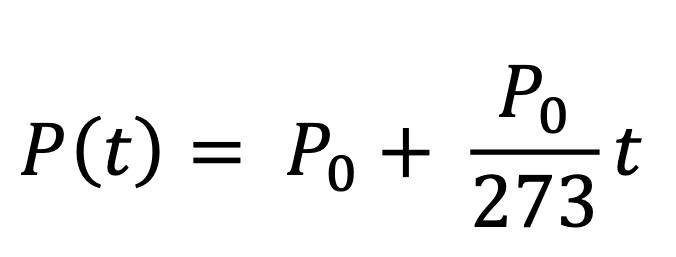
Questa è la seconda legge di Gay-Lussac, pubblicata nel 1802. Se usiamo la temperatura in gradi Kelvin, la formula si semplifica, e diventa:
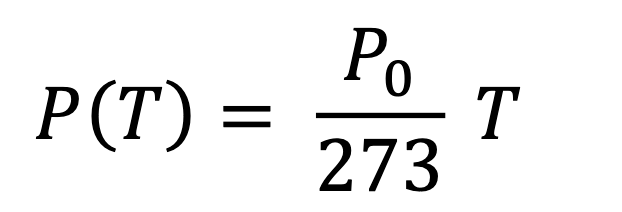
Attenzione! Il nostro P0 NON È un valore costante: dipende dal volume a cui abbiamo condotto l’esperimento!
In conclusione, i gas seguono le seguenti tre leggi:
- Legge di Boyle, 1662: P∙V = costante (a temperatura costante);
- Legge di Charles, 1787: Vt = V0∙T/273 (a pressione costante);
- Seconda legge di Gay-Lussac, 1802: Pt = P0∙T/273 (a volume costante).
Soddisfatti? Voi mi dite, in coro: bello, ma tre leggi! Non possiamo averne una sola? Io rispondo: bravi! la legge esiste e ne parleremo in un altro articolo.

